
FDA Лицензия на вакцину против чикунгунья приостановлена после «серьезных неблагоприятных событий» ?
Федеральные регуляторы 25 августа заявили, что они приостановили одобрение вакцины против чикунгунья, вируса, переносимого комарами.
Из-за сообщений о серьезных нежелательных явлениях после введения вакцины, Центр оценки и исследований биопрепаратов Управления по контролю за продуктами и лекарствами (CBER) «считает, что эта вакцина небезопасна и что дальнейшее введение в обществе представляет опасность для здоровья». Об этом говорится в заявлении FDA.
Французская компания Valneva производит вакцину, известную как Ixchiq.
«По мере того, как мы определяем потенциальные дальнейшие шаги, и по мере того, как явная угроза чикунгунья продолжает обостряться во всем мире, Valneva остается полностью привержена сохранению доступа к нашей вакцине в качестве глобального инструмента здравоохранения для решения и предотвращения вспышек этой разрушительной болезни», - сказал Томас Лингельбах, генеральный директор Valneva.

Захарт Штибер сообщает The Epoch Times, что FDA первоначально одобрило Ixchiq в 2023 году для предотвращения заболевания, вызванного вирусом чикунгунья у взрослых, которые, как считается, имеют повышенный риск воздействия. Центры по контролю и профилактике заболеваний в 2024 году рекомендовали вакцину для людей, путешествующих в определенные страны.
В мае чиновники здравоохранения сообщили, что они советуют приостановить введение вакцины пожилым людям из-за сообщений о том, что некоторые из вакцинированных испытывали серьезные побочные эффекты, включая неврологические и сердечные проблемы.
Это включало 38 отчетов SAE по 32 уникальным случаям (7 в США, 25 иностранных), включая 21 госпитализацию и три смерти.
После того, как директор CBER д-р Виней Прасад подал в отставку, FDA в начале августа прекратило рекомендованную приостановку, заявив, что обновленная оценка рисков и преимуществ для Ixchiq показала, что преимущества все еще перевешивают риски для некоторых людей.
В новом объявлении регуляторы заявили, что это больше не так.
Последняя оценка риска и пользы включает в себя четыре новых зарубежных отчета, которые появились после того, как FDA сняло рекомендованную паузу, включая отчет о проблемах после вакцинации у 55-летнего мужчины.
В меморандуме, датированном 22 августа, Прасад сказал, что из 32 случаев пять дали положительный результат на вакцинный штамм вируса.
«Существуют разумные основания полагать, что риски, связанные с вакциной, перевешивают ее преимущества и что она представляет опасность для здоровья. Таким образом, CBER приостанавливает одобрение. Прасад сказал.
Чикунгунья вызывает симптомы у большинства людей, инфицированных вирусом, согласно CDC. Симптомы могут включать лихорадку, боль в суставах и воспаление.
Другая вакцина против чикунгунья, Vimkunya, все еще доступна в Соединенных Штатах. FDA одобрило его в апреле для людей в возрасте 12 лет и старше, и CDC рекомендует его для людей, путешествующих в районы со вспышками чикунгунья, а также для лабораторных работников, которые могут подвергнуться воздействию вируса в своей работе.
Вимкуня использует молекулу, напоминающую вирус чикунгунья, чтобы вызвать иммунный ответ. Ixchiq содержит ослабленную форму вируса.
Акции Valneva упали примерно на 21% после приостановки деятельности FDA.
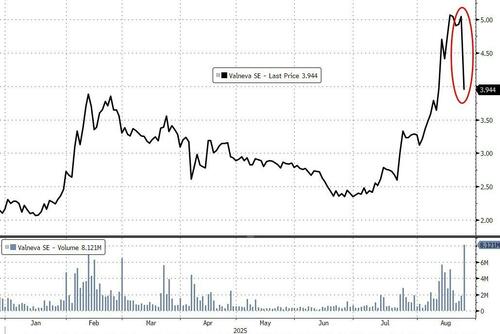
Валнева описала переезд как внезапный. Компания заявила, что SAE, зарегистрированные после вакцинации, имели симптомы, соответствующие тем, которые были зарегистрированы во время клинических испытаний, и что на этикетках точно перечислены предупреждения и меры предосторожности.
Ярлык предупреждал, что Ixchiq может вызвать «серьезную, тяжелую или продолжительную болезнь, похожую на чикунгунью», ссылаясь на данные испытаний и отчеты после одобрения.
«Valneva продолжает подробно расследовать эти случаи и, если это оправдано, будет предпринимать дальнейшие шаги в связи с решением FDA в соответствии с применимыми законодательными процедурами», — говорится в заявлении.
Тайлер Дерден
Мон, 08/25/2025 - 17:20







![Uciekła po kolizji przed halą im. A. Gołasia. Policja w Ostrołęce szuka kierującej srebrną toyotą [WIDEO]](https://www.eostroleka.pl/luba/dane/pliki/zdjecia/2025/kolizja_hala_golasia.jpg)




